伦理审查流程及要求
伦理审查流程及要求
适用于临床试验(包括药物、医疗器械含IVD)项目的伦理审查。
伦理审查流程图
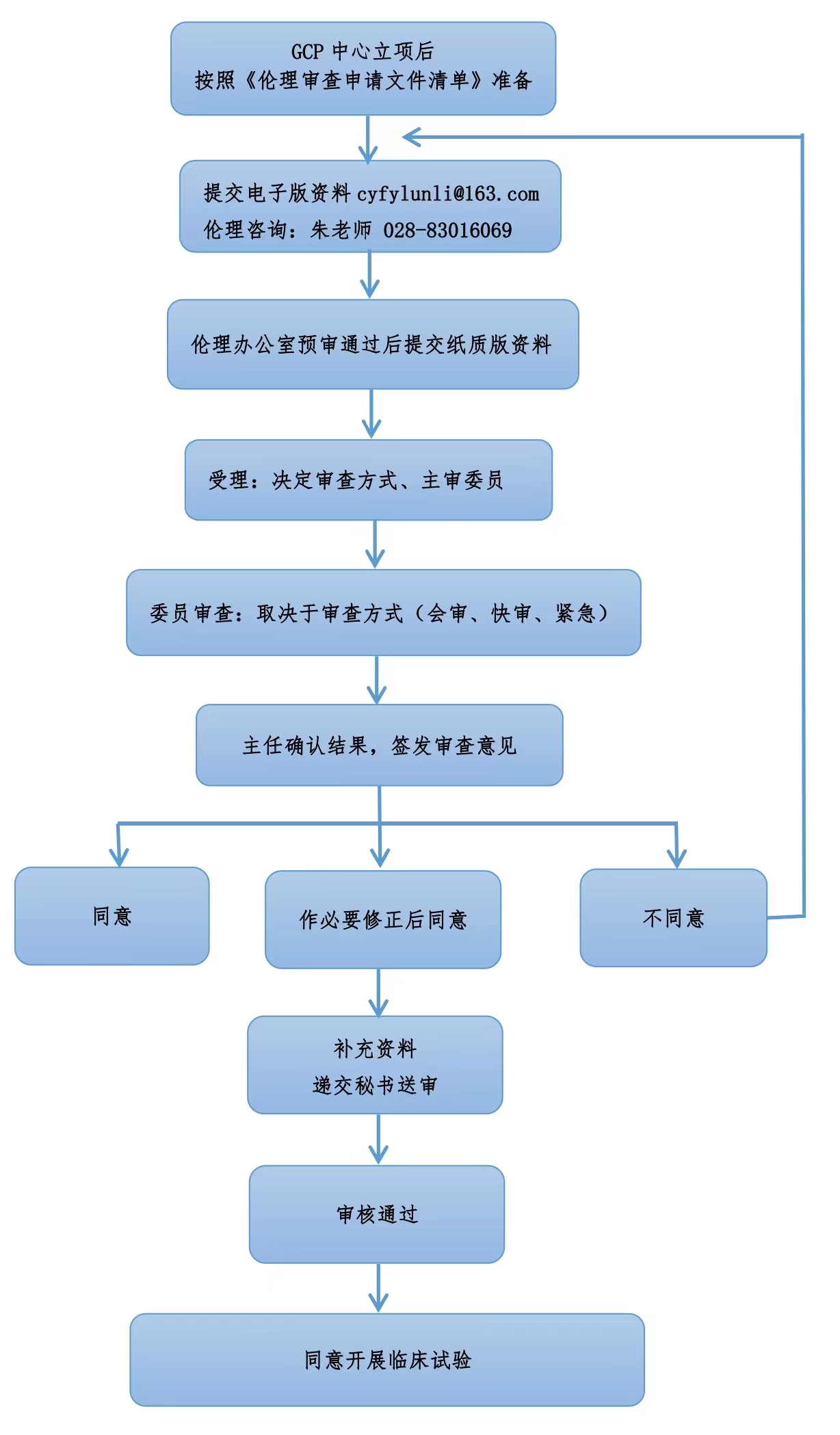
Tel:028-83016069(朱青芝)
邮箱:cyfylunli@163com
咨询时间:周一至周五工作日
08:00—12:00;14:30—17:30
经办地点:科教楼二楼伦理委员会办公室
资料准备与递交要求
资料准备
1、资料准备严格按照《伦理审查申请文件清单》进行。
2、所递交资料应保证真实性,若审查发现资料与实际不符,资料将被退回。
3、立项资料与伦理递交资料应完全一致,如在伦理递交阶段资料有更新或补充,请递交立项资料更新说明(列明变更文件名、版本号及日期等信息),临床试验中心重新审核并签字。
1、电子版资料的递交:伦理邮箱 cyfylunli@163.com。
⑴以压缩包形式发送,邮件主题为“科室-PI-药物或医疗器械名称-伦理材料”,如:呼吸-张三-××药物-伦理材料”。
⑵单个文件命名方式为“序号-文件名称-版本号-版本日期”;未按要求发送的邮件不予处理;电子版审核通过后将告知文件夹递交时间。
2、纸质资料的递交:
⑴电子版资料递交后,伦理秘书形式审查后微信/电话通知相关人员,到现场递交纸质版资料(请注意各方签字、盖鲜章)。
⑵递交时间
·工作日周一至周五 08:30—11:50;14:30—17:20
⑶现场递交资料:
·完整的伦理纸质文件2套,用并隔页纸隔开后装订成册。
·两套资料均需按照递交伦理目录排序,不得私自调换文件顺序。
伦理文件请装订成册,示例如下:

(药物、医疗器械用)

(诊断试剂用)
相关表格模板,请正确下载与使用。
附件一:药物临床试验伦理审查申请文件清单
附件二:医疗器械临床试验伦理审查申请文件清单
附件三:诊断试剂临床试验伦理审查申请文件清单
