临床试验安全性事件报告流程
发布时间:2023.03.20
来源部门:药学部.GCP
临床试验安全性事件报告流程
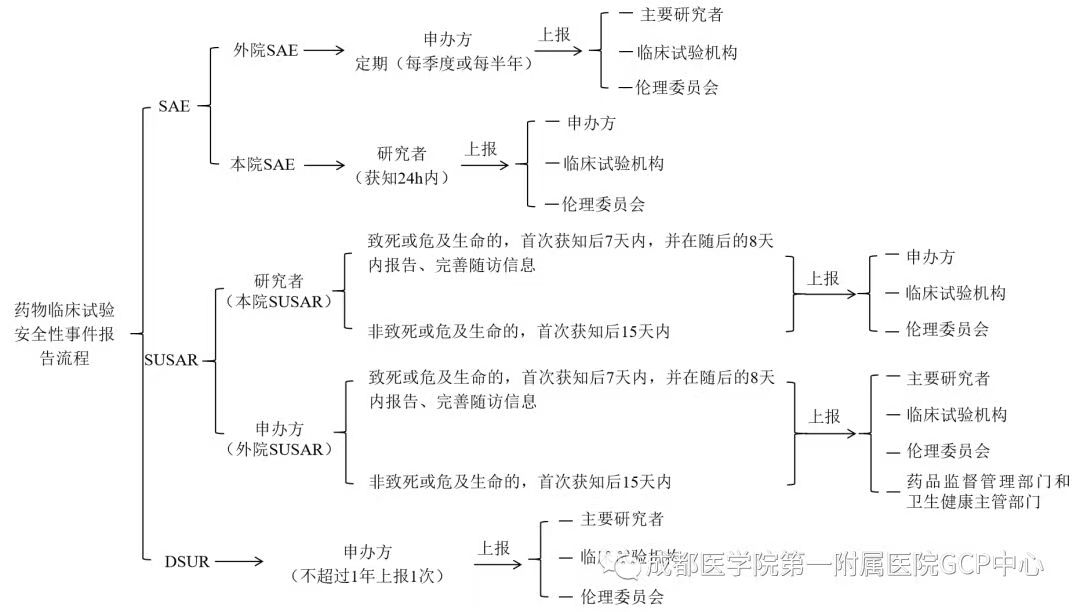
注:SAE(包含SUSAR)跟踪随访要求:申办方在首次报告后,应继续跟踪SAE(包含SUSAR),以随访报告形式及时报送给主要研究者及其所在临床试验机构、伦理委员会相关新信息或对前次报告的更改信息等,报告时限为获得新信息起15天内。
参考文件:
1. ICH-E2F 及 CDE 《研发期间安全性更新报告要求及管理规定》;
2.《药物临床试验期间安全性数据快速报告标准和程序》;
3.《药物临床试验质量管理规范2020版》

参考文件:
1.《医疗器械临床试验质量管理规范2022版》
成都医学院第一附属医院GCP中心办公室
编辑者:曾佳欣,撰写者:钟月玲,审核者:蒋 婷
本文由成都医学院第一附属医院GCP中心原创,未经许可严禁任何个人/团体进行转载。
